علاج الخلايا التائية المعدلة وراثياً: ثورة في علاج السرطان بالابتكار وسهولة الوصول
دخل علاج السرطان عصرًا جديدًا مع علاج الخلايا CAR-T، وهو شكل متقدم من العلاج المناعي يُحدث تحولًا في نتائج المرضى المصابين بأنواع معينة من السرطان. في هذا العرض الشامل، نشرح ما هو علاج CAR-T، وكيف يعمل، ومن يمكنه الاستفادة منه، وكيف تسهم البرامج الجديدة – بما في ذلك مبادرة مستشفى برجيل في أبوظبي بدولة الإمارات – في جعل هذا العلاج المنقذ للحياة أكثر توفرًا.
ما هي المعالجة بالخلايا التائية المعدلة وراثياً CAR-T؟
العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) يرمز إلى العلاج بالخلايا التائية ذات المستقبل المضاد الوهمي. وهو علاج متخصص يستخدم خلايا المناعة الخاصة بالمريض (الخلايا التائية) لمحاربة السرطان. يُعتبر العلاج بـ CAR-T نوعاً من العلاج الجيني القائم على الخلايا، لأن الخلايا التائية للمريض يتم تعديلها وراثياً في المختبر لمساعدتها على التعرف على الخلايا السرطانية وتدميرها. هذا النهج يحول خلايا المناعة للمريض بشكل أساسي إلى “أدوية حية” تستمر في التكاثر ومحاربة السرطان مع مرور الوقت.
العلاج بخلايا CAR-T أظهر نجاحاً ملحوظاً في علاج أنواع معينة من سرطانات الدم – خاصة اللوكيميا واللمفوما – التي لم تستجب للعلاجات التقليدية. في بعض الحالات، يمكن لعلاج CAR-T أن يقضي على جميع علامات السرطان (الشفاء التام)، حتى عندما تفشل العلاجات الأخرى. بسبب هذه النتائج، ولّد علاج CAR-T الأمل كعلاج محتمل أو سيطرة طويلة المدى على السرطانات العدوانية.
ومع ذلك، فإن العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) ليس علاجاً من الخط الأول وعادة ما يُعتبر عندما لا تنجح العلاجات المعيارية (مثل العلاج الكيميائي أو زراعة الخلايا الجذعية) أو عندما يعود السرطان (ينتكس). وهو معتمد حالياً بشكل أساسي لأنواع معينة من سرطانات الدم مثل: سرطان الدم الليمفاوي الحاد (ALL)، والليمفوما الكبيرة الخلايا البائية المنتشرة (DLBCL) وبعض الليمفومات اللاهودجكينية الأخرى، وليمفوما الخلايا الجدارية، والليمفوما الجريبية، والورم النقوي المتعدد. تستمر الأبحاث لتوسيع العلاج بالخلايا التائية المعدلة وراثياً ليشمل أنواع سرطان أخرى، بما في ذلك بعض الأورام الصلبة، لكن معظم النجاحات حتى الآن كانت في سرطانات الدم.
كيف يعمل العلاج بخلايا CAR-T
العلاج بخلايا CAR-T هو عملية متعددة الخطوات تعدل خلايا T الخاصة بالمريض لمهاجمة السرطان. إليك نظرة عامة على كيفية عمله:
- جمع الخلايا التائية: يقوم الأطباء أولاً بجمع الخلايا التائية من مجرى دم المريض. يتم ذلك عبر إجراء يُسمى فصل الكريات البيض، والذي يفصل خلايا الدم البيضاء (بما في ذلك الخلايا التائية) من الدم ويعيد باقي الدم إلى الجسم. تتم عملية الجمع في مركز متخصص ويمكن أن تستغرق بضع ساعات.
- التعديل الوراثي: يتم إرسال الخلايا التائية بعد ذلك إلى المختبر حيث يتم هندستها وراثياً. يقوم العلماء بإدخال جين جديد في هذه الخلايا التائية يشفر مستقبلاً خاصاً يُسمى المستقبل المضاد الخيميري (CAR). هذا المستقبل المضاد الخيميري يشبه نظام تحديد المواقع المخصص الذي يجهز الخلايا التائية للتعرف على بروتين محدد (مستضد) على الخلايا السرطانية. على سبيل المثال، العديد من خلايا اللوكيميا واللمفوما تحتوي على مستضد يُسمى CD19، لذا يمكن للمستقبل المضاد الخيميري الذي يستهدف CD19 أن يوجه الخلايا التائية إلى تلك الخلايا السرطانية.
- توسع الخلايا: يتم إكثار الخلايا التائية المعدلة (التي تُسمى الآن “خلايا CAR-T”) في المختبر. خلال أسبوعين، ينمي المختبر مئات الملايين من هذه الخلايا CAR-T. يضمن هذا التوسع وجود خلايا كافية لشن هجوم على السرطان عند إعادتها إلى المريض. خلال هذا الوقت، قد يتلقى المريض العلاج الكيميائي (يُسمى أحياناً العلاج الكيميائي المستنزف للخلايا الليمفاوية) لإفساح المجال في الجهاز المناعي للخلايا CAR-T الواردة.
- حقن خلايا CAR-T: بعد التوسع، يتم حقن خلايا CAR-T مرة أخرى في مجرى دم المريض، بشكل مشابه لنقل الدم. بمجرد الحقن، تنتقل هذه الخلايا عبر الجسم للبحث عن الخلايا السرطانية التي تحتوي على المستضد المستهدف والارتباط بها. يرتبط مستقبل CAR الموجود على الخلية التائية بالخلية السرطانية، مما ينشط الخلية التائية لقتل السرطان. الخلايا التائية المهندسة لا تدمر الخلايا الورمية فحسب، بل تستمر أيضاً في العيش والتكاثر في الجسم لفترة من الوقت، مما يوفر مراقبة مستمرة ضد السرطان.
- تدمير الخلايا السرطانية: من خلال التعرف على “البصمة” المحددة للسرطان (المستضد)، يمكن لخلايا CAR-T مهاجمة الأورام بدقة. تعمل كـ”دواء حي” يتكاثر ويستمر، مما يوفر حماية طويلة المدى محتملة. في بعض المرضى، بقيت خلايا CAR-T في الجسم لأشهر أو حتى سنوات، مما حافظ على السرطان في حالة هدوء.
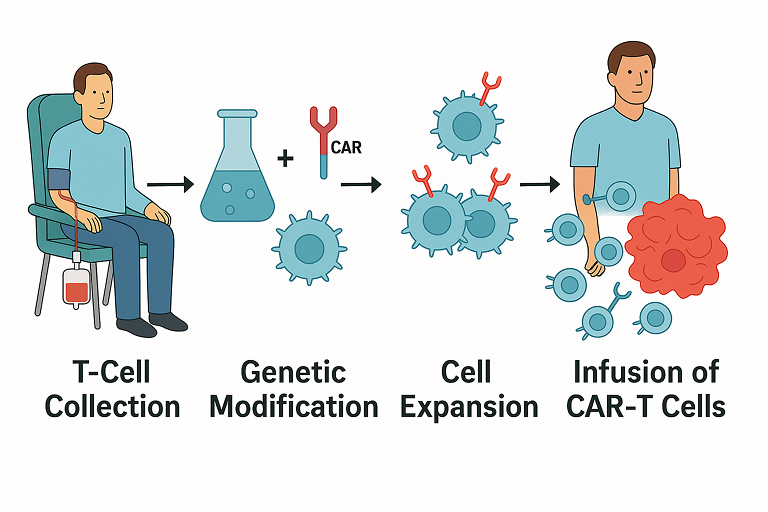
الشكل: نظرة عامة على كيفية إعطاء العلاج بالخلايا التائية المعدلة وراثياً (CAR T-cell). أولاً، يتم جمع الخلايا التائية من دم المريض في عملية تسمى فصل الكريات البيض. بعد ذلك، في المختبر يتم تعديل هذه الخلايا التائية وراثياً لتعبر عن مستقبل مستضد خيمري (CAR) يستهدف مستضد سرطاني محدد، ثم يتم إكثار الخلايا (تضاعفها). أخيراً، يتم حقن الخلايا التائية المهندسة (CAR-T) مرة أخرى في المريض، حيث تبحث عن الخلايا السرطانية وتدمرها.
هذه العملية الشخصية للغاية تعني أن كل جرعة من خلايا CAR-T فريدة للمريض. يمكن أن تستغرق العملية بأكملها من جمع الخلايا التائية إلى الحقن بضعة أسابيع لإكمالها. خلال هذه الفترة، يتم مراقبة المرضى عن كثب وقد يتلقون علاجاً للسيطرة على السرطان إذا لزم الأمر أثناء انتظار خلايا CAR-T الخاصة بهم.
فوائد ومعدلات نجاح العلاج بالخلايا التائية المعدلة وراثياً CAR-T
العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) أظهر نتائج مبهرة، خاصة في المرضى الذين استنفدوا خيارات العلاج الأخرى. تشمل بعض الفوائد والنتائج الرئيسية:
- معدلات شفاء عالية: أظهرت التجارب السريرية والدراسات معدلات شفاء أولية عالية في أنواع معينة من السرطان. على سبيل المثال، في دراسة أجريت على الأطفال المصابين بسرطان الدم الليمفاوي الحاد المتقدم، حقق أكثر من 85% شفاءً تاماً بعد علاج CAR-T. كما شهد العديد من مرضى الليمفوما البالغين الذين لم يستجيبوا للعلاج الكيميائي انكماش أورامهم أو اختفاءها بعلاج CAR-T.
- إمكانية الشفاء طويل المدى: يُوصف العلاج بالخلايا التائية المعدلة وراثياً أحياناً بأنه علاج “لمرة واحدة” يمكن أن يؤدي إلى تأثيرات طويلة الأمد. على عكس العلاج الكيميائي العادي الذي يتطلب دورات مستمرة، يُعطى العلاج بالخلايا التائية المعدلة وراثياً مرة واحدة (أو سلسلة قصيرة من الحقن الوريدي) ويمكن للخلايا المعدلة أن تبقى نشطة. في الدراسة المتعلقة بالأطفال المذكورة، بقي حوالي 60% من هؤلاء الأطفال خالين من السرطان لمدة عام واحد بعد حقنة واحدة من العلاج بالخلايا التائية المعدلة وراثياً. في بعض المرضى، استمرت الخلايا التائية المعدلة وراثياً وحافظت على السيطرة على السرطان لسنوات. هذا يقدم أملاً في أن العلاج بالخلايا التائية المعدلة وراثياً يمكن أن يكون علاجاً شافياً لمجموعة فرعية من المرضى، رغم أنه ليس كل شخص سيحصل على شفاء دائم.
- فعالية “الملاذ الأخير”: ربما تكون الفائدة الأكثر تميزاً هي أن العلاج بالخلايا التائية المعدلة وراثياً يمكن أن يعمل عندما تفشل العلاجات الأخرى. المرضى المصابون بسرطانات الدم المنتكسة أو المقاومة للعلاج – الذين ربما خضعوا لجولات متعددة من العلاج الكيميائي أو الإشعاعي أو حتى زراعة نخاع العظم – قد حصلوا على فرصة جديدة للحياة بفضل العلاج بالخلايا التائية المعدلة وراثياً. بالنسبة لهؤلاء الأفراد، يمكن أن يكون هذا العلاج منقذاً للحياة حقاً، حيث يقدم معدلات استجابة أعلى بكثير من أي خيار آخر متاح لمرض المرحلة النهائية.
- الطب الدقيق: تستهدف خلايا CAR-T الخلايا السرطانية بشكل محدد من خلال مستضدها، مما يقلل من الضرر الذي يلحق بالخلايا السليمة. إنه شكل من أشكال الطب الدقيق. على سبيل المثال، علاجات CAR-T ضد مستضد CD19 ستبحث عن خلايا سرطان الدم أو الليمفوما من النوع B التي تحمل CD19، مع الحفاظ إلى حد كبير على الخلايا الأخرى. هذا يختلف عن العلاج الكيميائي، الذي يهاجم جميع الخلايا سريعة الانقسام (السليمة والسرطانية على حد سواء). ومع ذلك، لأن CD19 موجود أيضاً على خلايا B الطبيعية، فإن المرضى الذين يتلقون علاج CD19 CAR-T سيفقدون مؤقتاً خلايا B الطبيعية أيضاً، ولكن يمكن التحكم في هذا وغالباً ما يكون مقايضة مقبولة للقضاء على السرطان.
رغم هذه الفوائد، من المهم الإقرار بأن العلاج بخلايا CAR-T لا يعمل مع الجميع. قد تشهد نسبة كبيرة من المرضى عودة السرطان في النهاية أو قد لا يستجيبون بشكل كامل لعلاج CAR-T. يدرس الباحثون بنشاط أسباب عدم استجابة بعض المرضى أو انتكاسهم، وكيفية تحسين تصاميم خلايا CAR-T لجعل فترات الشفاء أكثر دواماً.
المخاطر والآثار الجانبية: لماذا يُعطى العلاج بالخلايا التائية المعدلة وراثياً في مراكز متخصصة
العلاج بخلايا CAR-T هو علاج قوي، ولكنه قد يسبب أيضاً آثاراً جانبية خطيرة تتطلب إدارة متخصصة. لهذا السبب، لا يُقدم علاج CAR-T إلا في المستشفيات المتخصصة التي تملك التدريب والبنية التحتية اللازمة. اثنان من أهم الآثار الجانبية هما:
- متلازمة إطلاق السيتوكين (CRS): عندما تقتل خلايا CAR-T السرطان، يمكن أن تؤدي إلى استجابة مناعية هائلة. قد تطلق الخلايا المناعية كميات كبيرة من السيتوكينات (المواد الكيميائية الالتهابية)، مما يؤدي إلى متلازمة إطلاق السيتوكين. يمكن أن تشمل الأعراض حمى شديدة، قشعريرة، انخفاض في ضغط الدم، صعوبة في التنفس، وخلل في وظائف الأعضاء. في الحالات الشديدة، تكون متلازمة إطلاق السيتوكين مهددة للحياة وقد يحتاج المرضى إلى رعاية مركزة (مثل الأدوية لرفع ضغط الدم، الأكسجين أو دعم جهاز التنفس الصناعي). يمتلك الأطباء الآن خبرة في إدارة متلازمة إطلاق السيتوكين باستخدام أدوية محددة (مثل توسيليزوماب، وهو مثبط للمناعة) لتهدئة التفاعل المناعي إذا أصبح شديداً جداً.
- السمية العصبية: يصاب بعض المرضى بآثار جانبية عصبية بعد حقن خلايا CAR-T. قد يعانون من الارتباك، والهياج الشديد، والرعشة، وصعوبة في الكلام، أو حتى النوبات وفقدان الوعي في الحالات الشديدة. تُسمى هذه الحالة أحياناً بمتلازمة السمية العصبية المرتبطة بالخلايا المناعية المؤثرة (ICANS). عادة ما تحدث خلال أيام إلى أسبوعين بعد العلاج. رغم أنها مخيفة، إلا أن معظم التأثيرات العصبية مؤقتة وتختفي مع الرعاية الداعمة، لكن المراقبة الدقيقة ضرورية.
- الآثار الجانبية الأخرى: يمكن لعلاج CAR-T أن يضعف جهاز المناعة بشكل عام مؤقتاً. غالباً ما يعاني المرضى من انخفاض في عدد خلايا الدم ويكونون عرضة للإصابة بالعدوى، لذلك تتم مراقبتهم عن كثب للكشف عن الحمى أو علامات العدوى. قد يحتاج البعض إلى نقل دم أو مضادات حيوية أثناء فترة التعافي. يمكن أن يحدث أيضاً إرهاق أو غثيان أو آثار جانبية أخرى، لكن متلازمة إطلاق السيتوكين والسمية العصبية هما التحديان المميزان لعلاج CAR-T.
بسبب هذه المخاطر، يبقى المرضى الذين يتلقون علاج CAR-T عادة في المستشفى لبضعة أسابيع ويبقون بالقرب من المركز المعالج لفترة من الوقت بعد الحقن. تخضع الفرق الطبية التي تقوم بإعطاء علاج CAR-T لتدريب خاص، ويجب على المستشفيات الحصول على شهادات معينة لتقديم علاج CAR-T. هذا يضمن أنه في حالة حدوث آثار جانبية شديدة، يمكن للفريق التعرف عليها وعلاجها بسرعة.
الحاجة إلى رعاية متخصصة هي أحد الأسباب التي جعلت علاج CAR-T متاحاً فقط في عدد محدود من مراكز السرطان الكبرى حول العالم. إنه ليس علاجاً يمكن لعيادة صغيرة تقديمه، نظراً لتعقيد تصنيع الخلايا والتعامل مع الآثار الجانبية.
تحديات التوفر والتكلفة لعلاج الخلايا التائية المعدلة وراثياً (CAR-T)
عندما تم اعتماد علاجات الخلايا التائية المعدلة وراثياً (CAR-T) لأول مرة حوالي عام 2017، مثلت اختراقاً في رعاية مرضى السرطان. ومع ذلك، جاءت أيضاً بتكاليف باهظة وتحديات لوجستية. في الولايات المتحدة وأوروبا، تحمل علاجات CAR-T أسعاراً تتجاوز بكثير 350,000 دولار للجرعة الواحدة، ويمكن أن تصل حتى إلى مليون دولار عند تضمين الرعاية الطبية في المستشفى. مثل هذه التكاليف تجعل العلاج بعيد المنال عن العديد من المرضى وأنظمة الرعاية الصحية. علاوة على ذلك، يتم تصنيع كل جرعة من CAR-T بشكل فردي، غالباً في مرافق مركزية (أحياناً حتى في بلد آخر)، مما يعني أوقات تسليم طويلة وسلاسل توريد معقدة.
تم تقييد الوصول العالمي: العديد من البلدان، خاصة في العالم النامي أو مناطق مثل الشرق الأوسط وأفريقيا وأجزاء من آسيا، لم تحصل على وصول ضئيل أو معدوم لعلاج CAR-T حتى وقت قريب. المرضى في تلك المناطق الذين يحتاجون إلى CAR-T كان عليهم السفر إلى الخارج (إذا كان بإمكانهم تحمل التكلفة) أو الانضمام إلى التجارب السريرية. تم تشبيه الوضع بعلاج “ثوري ولكن بعيد المنال” – شريان حياة حقيقي لا يستطيع سوى القليل التمسك به فعلياً.
العوائق الرئيسية لتوسيع توفر العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) كانت:
- تكلفة البضائع: تصنيع خلايا CAR-T مكلف. يتضمن مختبرات عالية التقنية، وناقلات فيروسية لتعديل الخلايا وراثياً، وضوابط جودة صارمة. تساهم المواد والعمالة في ارتفاع التكلفة لكل مريض.
- البنية التحتية: يتطلب إنتاج العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) مرافق تتبع ممارسات التصنيع الجيدة (GMP). حتى الآن، لا توجد سوى عدد قليل من هذه المرافق على مستوى العالم، ومعظمها في أمريكا الشمالية أو أوروبا أو شرق آسيا. إن شحن الخلايا عبر القارات ليس مستهلكاً للوقت فحسب، بل يضيف أيضاً مخاطر (قد تفقد الخلايا قابليتها للحياة) وتكلفة.
- الخبرة: يحتاج العلاج إلى خبراء مدربين – من علماء المختبرات الذين يتعاملون مع الخلايا، إلى الأطباء السريريين الذين يديرون المرضى خلال العلاج والآثار الجانبية. إن بناء هذه الفرق والمراكز المتخصصة يستغرق وقتاً.
- التنظيم والموافقة: يجب على كل دولة الموافقة على منتجات العلاج بالخلايا التائية المعدلة وراثياً أو التصنيع المحلي. هذا عائق تنظيمي لا تزال بعض المناطق تتعامل معه، خاصة إذا كانت تهدف إلى إنتاج علاجات الخلايا التائية المعدلة وراثياً محلياً بدلاً من الاستيراد من شركات الأدوية متعددة الجنسيات.
الأخبار الجيدة هي أن الجهود جارية على مستوى العالم للتغلب على هذه التحديات. الصين، على سبيل المثال، طورت منتجات CAR-T الخاصة بها بتكاليف أقل، مما أدى إلى انخفاض أسعار العلاج إلى عشرات الآلاف من الدولارات هناك. وهذا يدل على أن علاج CAR-T الأكثر تكلفة ممكن من خلال الابتكار المحلي.
الآن، الشرق الأوسط مهيأ أيضاً لجعل العلاج بالخلايا التائية المعدلة وراثياً أكثر إتاحة وبأسعار معقولة، وذلك بفضل المبادرات الجديدة مثل تلك التي تقوم بها مجموعة برجيل القابضة في دولة الإمارات العربية المتحدة.
علاج الخلايا التائية المعدلة وراثياً في دولة الإمارات العربية المتحدة: برنامج برجيل للعلاج بأسعار معقولة
إن أحد أكثر التطورات إثارة في توسيع الوصول إلى علاج CAR-T يحدث في دولة الإمارات العربية المتحدة، حيث أطلقت مدينة برجيل الطبية – جزء من مجموعة برجيل القابضة – برنامجاً لتصنيع علاجات خلايا CAR-T محلياً. بالشراكة مع منظمة أمريكية غير ربحية تُدعى كيرنغ كروس، تقوم برجيل بإنشاء مرفق حديث يتوافق مع معايير الممارسات التصنيعية الجيدة في أبوظبي لإنتاج خلايا CAR-T بجزء بسيط من التكلفة المعتادة.
ثورة في رعاية السرطان في منطقة الشرق الأوسط وشمال أفريقيا: هذا التعاون، الذي تم الإعلان عنه في أبريل 2025 خلال أسبوع أبوظبي العالمي للصحة، مُعد لإحداث ثورة في رعاية السرطان عبر منطقة الشرق الأوسط وشمال أفريقيا من خلال توفير علاج CAR-T بتكلفة أقل تصل إلى 90% من الأسعار الدولية. من الناحية العملية، العلاج الذي قد يكلف 400,000 دولار في الخارج يمكن أن يكون في حدود 40,000 دولار تحت برنامج برجيل – وهو تغيير جذري للمرضى وأنظمة الصحة في المنطقة. من خلال جلب التصنيع إلى داخل البلاد، يتم تقليل تكاليف اللوجستيات والوسطاء بشكل كبير، ويمكن توصيل العلاجات بشكل أسرع للمرضى المحتاجين.
كيف يعمل برنامج برجيل لعلاج CAR-T: تركز مبادرة برجيل على إنتاج خلايا CAR-T في نقطة الرعاية. بدلاً من استخدام النموذج التقليدي حيث يتم شحن الخلايا إلى مختبر شركة أدوية بعيدة، ستتمكن المنشأة الجديدة في أبوظبي من معالجة خلايا المرضى في الموقع، مع إمكانية التعامل مع ما يصل إلى 200 عينة مريض في وقت واحد بفضل معداتها المتطورة. تقدم شركة كيرنغ كروس، التي تتمتع بخبرة في إنتاج العلاج الخلوي منخفض التكلفة، التكنولوجيا والمواد الخام (مثل الناقلات الفيروسية العدسية المستخدمة لتعديل الخلايا التائية) والتدريب للفرق المحلية.
من خلال بناء القدرات المحلية، يعالج هذا البرنامج مسألتي القدرة على تحمل التكلفة وإمكانية الوصول. فهو يقلل من الاعتماد على استيراد منتجات العلاج بالخلايا التائية المعدلة وراثياً باهظة الثمن ويلغي التأخير الناجم عن التصنيع في الخارج. والرؤية هي وضع دولة الإمارات العربية المتحدة كمركز إقليمي للعلاج المتقدم بالخلايا والجينات، مما سيفيد ليس فقط المرضى في دولة الإمارات بل أيضاً أولئك من جميع أنحاء منطقة الشرق الأوسط وشمال أفريقيا وحتى جنوب آسيا الذين يمكنهم السفر إلى أبوظبي للحصول على العلاج المتطور.
التركيز الأولي والخطط المستقبلية: تركز المرحلة الأولى من برنامج برجيل للعلاج بالخلايا التائية المعدلة وراثياً على سرطانات الدم – تحديداً اللوكيميا والأورام اللمفاوية، وهي الأمراض التي أثبت فيها العلاج بالخلايا التائية المعدلة وراثياً فعالية عالية بالفعل. هذا يعني أن المرضى المصابين بسرطانات الدم العدوانية في المنطقة قد يحصلون قريباً على خيار محلي للعلاج بالخلايا التائية المعدلة وراثياً، مما يحسن بشكل كبير من توقعات شفائهم. وبالنظر إلى المستقبل، تعتزم الشراكة أيضاً استكشاف العلاج بالخلايا التائية المعدلة وراثياً والعلاجات الخلوية المماثلة لأمراض خطيرة أخرى؛ ومن المثير للاهتمام أن هناك خططاً لبحث التطبيقات لأمراض مثل فيروس نقص المناعة البشرية في المستقبل. هذا يشير إلى أن البنية التحتية التي يتم وضعها يمكن أن تُستغل مع الوقت خارج نطاق علم الأورام، مما قد يساهم في إيجاد علاجات للأمراض الفيروسية أو حالات أخرى باستخدام العلاجات القائمة على الخلايا.
التأثير على المرضى والرعاية الصحية: بالنسبة للمرضى، يمكن أن يعني برنامج برجيل للعلاج بالخلايا التائية المعدلة وراثياً علاجاً منقذاً للحياة دون التكلفة الباهظة. العديد من العائلات في الماضي ربما واجهت الواقع المؤلم أنه حتى لو كان بإمكان العلاج بالخلايا التائية المعدلة وراثياً إنقاذ أحبائهم، فإنهم ببساطة لا يستطيعون تحمل تكلفته أو الوصول إليه. مع الإنتاج المحلي، يمكن علاج المزيد من المرضى، وبشكل أسرع بكثير بعد الحاجة للعلاج. يركز هذا البرنامج أيضاً على تدريب مقدمي الرعاية الصحية المحليين وبناء الخبرات، مما يساهم في نظام بيئي مستدام. على المدى الطويل، يمكن أن يدفع الابتكار والبحث في المنطقة، ويجذب التجارب السريرية والمواهب، مما يعزز خيارات العلاج المتاحة محلياً.
من الجدير بالذكر أن هذه المبادرة في دولة الإمارات العربية المتحدة تتماشى مع اتجاه عالمي أوسع: التحرك نحو العلاجات المتقدمة اللامركزية المنتجة محلياً. من خلال تقليل الاعتماد على عدد قليل من مواقع التصنيع عالمياً، تأمل هذه النماذج في ضمان العدالة في الرعاية الصحية – بحيث لا يكون الاختراق مثل علاج CAR-T مجرد أمل للمرضى في البلدان الغنية، بل واقعاً للمرضى في كل مكان.
مستقبل العلاج بالخلايا التائية المعدلة وراثياً: ما يمكن للمرضى توقعه
العلاج بخلايا CAR-T هو مجال متطور. منذ الموافقة على أول علاجات CAR-T في عام 2017، يوجد الآن ستة علاجات CAR-T معتمدة من إدارة الغذاء والدواء الأمريكية لأنواع مختلفة من اللوكيميا واللمفوما والورم النقوي المتعدد، والتجارب الجارية تستكشف أهدافاً جديدة وأنواع سرطان جديدة. الباحثون يعملون حتى على أجيال أحدث من خلايا CAR-T قد تعمل في الأورام الصلبة (مثل سرطان الرئة أو الدماغ) وعلى جعل خلايا CAR-T “جاهزة للاستخدام” (باستخدام خلايا المتبرعين، بحيث تكون متاحة فوراً دون أسابيع التصنيع الطويلة لكل مريض).
بالنسبة للمرضى والجمهور العام، إليكم بعض النقاط الأساسية حول ما يحمله المستقبل:
- المزيد من مراكز العلاج حول العالم: كما هو واضح مع برنامج برجيل، من المرجح أن تبدأ مراكز أكثر حول العالم في تقديم العلاج بالخلايا التائية المعدلة وراثياً CAR-T، إما من خلال الشراكة للتصنيع محلياً أو من خلال الحصول على التكنولوجيا. هذا يعني أن المرضى قد لا يضطرون للسفر لمسافات بعيدة لتلقي علاج CAR-T في المستقبل.
- تكاليف أقل مع مرور الوقت: تماماً كما رأينا في دولة الإمارات العربية المتحدة مع مبادرة تقليل التكلفة بنسبة 90%، من المتوقع أن تؤدي المنافسة والابتكار إلى خفض التكاليف. النماذج غير الربحية (مثل كيرنغ كروس) والمراكز الأكاديمية تطور علاجات CAR-T قد تكون أرخص من المنتجات التجارية. في غضون سنوات قليلة، قد يصبح علاج CAR-T أكثر قابلية للتحمل، ونأمل أن تغطيه شركات التأمين أو الحكومات بسبب فوائده المثبتة.
- التطبيقات الأوسع للأمراض: بينما يُستخدم العلاج بالخلايا التائية المعدلة وراثياً (CAR-T) اليوم بشكل أساسي لأنواع معينة من سرطانات الدم، قد نراه غداً يُستخدم لأنواع أخرى من السرطان أو حتى للأمراض غير السرطانية. التجارب السريرية جارية لاستخدام العلاج بالخلايا التائية المعدلة وراثياً في أمراض المناعة الذاتية (مثل الذئبة الحمراء أو التصلب المتعدد) والأمراض المعدية. إن مبدأ تمكين الخلايا المناعية وراثياً له مجموعة واسعة من الاستخدامات المحتملة.
- تمكين المرضى والتعليم: مع العلاجات المتطورة للغاية مثل CAR-T، يعتبر تعليم المرضى أمراً بالغ الأهمية. تقوم المستشفيات بإنشاء موارد لمساعدة المرضى على فهم ما يمكن توقعه، والناجون من السرطان الذين عولجوا بـ CAR-T يتشاركون تجاربهم. هذا يبني المعرفة المجتمعية والراحة مع العلاج. إذا كنت أنت أو أحد أحبائك مصاباً بسرطان قد يُعالج بـ CAR-T، فمن المهم استشارة طبيب أورام لديه خبرة في هذا المجال. يمكنهم شرح الأهلية والعملية والفوائد المحتملة والمخاطر بالتفصيل.
- البحث والتحسين المستمر: يتعلم المجتمع الطبي المزيد كل يوم – على سبيل المثال، كيفية تقليل الآثار الجانبية مثل متلازمة إطلاق السيتوكين، وكيفية اختيار المرضى الأكثر احتمالاً للاستفادة، وكيفية تحسين خلايا CAR-T بحيث تدوم لفترة أطول في الجسم. هناك أكثر من 1000 تجربة سريرية لـ CAR-T جارية في جميع أنحاء العالم، مما يؤكد الجهد الهائل لتحسين وتوسيع هذا العلاج. يمكننا أن نتوقع أن يصبح علاج CAR-T أكثر أماناً وفعالية مع مرور الوقت مع إثمار هذه الدراسات.
الخلاصة
العلاج بخلايا CAR-T يمثل زواجاً رائعاً بين العلم الحديث والطب – حيث يستفيد من جهاز المناعة الطبيعي في الجسم، المعزز بالهندسة الوراثية، لمحاربة السرطان. لقد غير بالفعل حياة العديد من المرضى الذين لم يكن لديهم أمل آخر، حيث يقدم الشفاء وحتى العلاج التام في بعض الحالات الخطيرة. وكما هو الحال مع أي اختراق علمي، كانت هناك تحديات في جعله متاحاً على نطاق واسع، من إدارة الآثار الجانبية إلى التكلفة العالية وعملية التصنيع المعقدة.
اليوم، نقف عند نقطة تحول تبعث على الأمل. فمبادرات مثل تلك التي أطلقها مستشفى برجيل في أبوظبي بدولة الإمارات تكسر حواجز التكلفة والوصول إلى العلاج، مجسّدة المبدأ القائل بأن الابتكارات الطبية يجب أن تعود بالنفع على الجميع، لا على فئة محدودة فقط. ومن خلال الجمع بين الخبرات العالمية والعمل المحلي، تقترب هذه البرامج بالعلاجات المتقدمة من المرضى الذين هم في أمسّ الحاجة إليها.
بالنسبة للمرضى والعائلات الذين يواجهون أنواع السرطان مثل اللوكيميا أو الليمفوما، يقدم العلاج بخلايا CAR-T شعاعاً جديداً من الأمل. إذا كنت أنت أو شخص تعرفه تواجهون تشخيص السرطان، فمن المفيد مناقشة الأمر مع فريقك الطبي حول ما إذا كان العلاج بخلايا CAR-T خياراً متاحاً، سواء كجزء من الرعاية المعيارية أو من خلال التجارب السريرية. بفضل الخبرة المتزايدة والبرامج المتوسعة في جميع أنحاء العالم، يصبح هذا العلاج الذي كان تجريبياً في السابق بسرعة جزءاً من الترسانة المعيارية في رعاية السرطان – مثال ملهم على كيف يمكن للابتكار والتعاون والالتزام برفاهية المرضى أن يحدث ثورة في ما هو ممكن في الطب.

